Een groep Nederlandse onderzoekers heeft in het lab embryo-achtige structuren gemaakt van stamcellen van muizen, zonder dat daar een ei- of zaadcel aan te pas kwam. Deze kunstmatige embryo’s bieden onderzoekers de mogelijkheid het prille begin van een zwangerschap te bestuderen. Het resultaat is gepubliceerd in Nature.
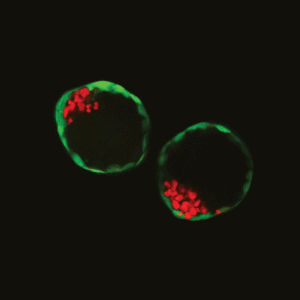
De structuur van de kunstmatige muizenembryo’s is vergelijkbaar met die van een natuurlijk embryo enkele dagen na de bevruchting. De kunstmatige embryo’s zien er bijna hetzelfde uit en vertonen dezelfde soort activiteit in de genen. ‘Ze zijn onder de microscoop bijna niet van natuurlijke te onderscheiden’, zegt Nicolas Rivron, werkzaam bij het MERLN Instituut in Maastricht en het Hubrecht Instituut in Utrecht.

Oudere spier kampt met haperende energievoorziening
Wat gebeurt er met je spieren als je ouder wordt? De achteruitgang een spier blijkt het gevolg te zijn van een haperende energievoorziening.
Het prille begin
Er is nog veel onbekend over het begin van een zwangerschap. Juist in de eerste dagen gaat er vaak iets mis, waardoor de zwangerschap stopt. En als de zwangerschap wel doorzet, kunnen kleine foutjes die in deze periode ontstaan, resulteren in aandoeningen zoals hart- en vaatziekten. ‘Door jonge embryo’s in deze eerste fase te bestuderen, kunnen we misschien achterhalen hoe deze fouten ontstaan en hoe we ze kunnen voorkomen’, zegt Rivron.
Maar het bestuderen van embryo’s is lastig. Ze zitten meestal goed verborgen in de baarmoeder en zijn erg klein – ongeveer de dikte van een haar. Bovendien zijn er weinig embryo’s beschikbaar en moet je er voorzichtig mee omgaan. ‘Door kunstmatige embryo’s uit stamcellen te kweken, kunnen we grote hoeveelheden maken om ze te bestuderen’, zegt Rivron. Dat kan kostbare embryo’s en proefdierlevens schelen.
Blastocyste

De embryo-achtige structuur die de onderzoekers maakten, is vergelijkbaar met een erg vroege fase van een embryo, genaamd blastocyste (ook wel bekend als blastula). Ongeveer vijf dagen nadat een eicel bevrucht is, ontwikkelt die zich tot een blastocyste. Dit is een hol bolletje dat slechts uit enkele tientallen cellen bestaat.
De buitenste laag cellen van de blastocyste (de trophoblast) zal zich gaan hechten aan het baarmoederslijmvlies en de placenta vormen. Het klompje binnenin bestaat uit een ander soort cellen (de embryoblast) en zal zich ontwikkelen tot de embryo.
De onderzoekers kweekten eerst, apart van elkaar, de trophoblast-cellen en de embryoblast-cellen uit stamcellen. Vervolgens brachten ze de twee celtypen in precies afgemeten hoeveelheden samen in microscopisch kleine holtes. Daarna creëerden ze de juiste combinatie van omgevingsfactoren waardoor de cellen zelfstandig een blastocyste-achtige structuur gingen vormen. Hierbij communiceren de twee celtypen met elkaar door signalen uit te wisselen.
Door deze communicatie te bestuderen, hopen de onderzoekers te begrijpen hoe er fouten kunnen ontstaan tijdens deze eerste, kwetsbare fase. ‘Met die informatie kunnen we er misschien voor zorgen dat kunstmatige bevruchtingen, zoals ivf, minder vaak mislukken’, zegt Rivron. ‘Of we kunnen het omgekeerde doen en betere anticonceptie ontwikkelen.’
Minder proefdieren
‘Het is een spannende tijd voor onderzoek naar embryonale ontwikkeling’, zegt Magdalena Zernicka-Goetz van de University of Cambridge. ‘De ontwikkelingen in verschillende labs zijn belangrijk stappen om de beginfase van leven beter te begrijpen. En hopelijk zijn er in de toekomst, dankzij kunstmatige embryo’s, minder proefdieren nodig voor dit onderzoek.’

Zernicka-Goetz publiceerde vorig jaar met haar onderzoeksgroep een onderzoek waarbij ze ook muizenembryo-structuren maakten uit stamcellen. Maar deze structuren leken meer op embryo’s die al ingenesteld waren. Bovendien bevatten ze nog niet alle weefseltypen die nodig zijn om een embryo verder te laten groeien.
De kunstigmatige embryo’s van de onderzoeksgroep onder leiding van Rivron hebben dat wel. ‘Ze zijn completer en bootsen een eerdere fase van de embryogroei na’, zegt Rivron. ‘Bovendien zijn het de eerste kunstmatige embryo’s die zich kunnen nestelen in een baarmoeder en die in theorie uit zouden kunnen groeien tot een volledig organisme.’ Maar zover is het onderzoek nog niet. Nu leven de kunstmatige embryo’s na nesteling in de baarmoeder van een muis niet langer dan twee dagen.
Mis niet langer het laatste wetenschapsnieuws en meld je nu gratis aan voor de nieuwsbrief van New Scientist.
Lees verder:

