Voor het eerst hebben wetenschappers uit twee soorten stamcellen in een schaaltje kunstmatige muizenembryo’s gevormd. Bijzonder is vooral dat hier geen eicel aan te pas kwam. Bij kloontechnieken, zoals die gebruikt bij Dolly het schaap, zijn wel altijd eicellen nodig.
Kunstmatige muizenembryo’s gekweekt vanuit stamcellen kunnen helpen om de geheimen van de embryonale ontwikkeling te ontrafelen. Ook kunnen ze meer inzicht in de problemen bij een miskraam geven.

Virtueel massagraf leert ons lugubere maar waardevolle lessen
Hayley Mickleburgh bestudeert de ontbinding van lichamen in massagraven. Met de opgedane kennis ontwikkelt ze een virtueel massagraf.
Magdalena Zernicka-Goetz van de University of Cambridge en haar onderzoeksgroep maakten de muizenembryo’s door embryonale stamcellen te gebruiken. Deze cellen komen uit embryo’s en kunnen uitgroeien tot elk type weefsel in het lichaam.
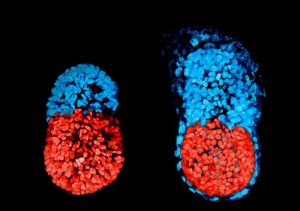
Hun truc was om ook trofoblast-stamcellen te kweken. Deze cellen vormen normaal de placenta. De twee soorten stamcellen groeiden eerst apart en daarna samen in een speciale gietvorm van gel. De twee stamcellen vermengden zich in de gietvorm en begonnen zich samen te ontwikkelen.
Na ongeveer vier en een halve dag leken de kunstmatige embryo’s op normale muizenembryo’s die zich klaarmaken om zich te ontwikkelen tot verschillende lichaamsweefsels en organen. ‘We voegden de twee soorten stamcellen samen zodat ze konden communiceren. Dit was nog nooit eerder gedaan. We zagen dat de cellen zichzelf aanstuurden zonder onze hulp’, zegt Zernicka-Goetz.
Lichaamsontwerp
De kunstmatige muizenembryo’s geven nieuwe inzichten in hoe embryo’s zichzelf aansturen en hoe ze ontwikkelen, zegt Zernicka-Goetz. De onderzoeksgroep maakte de embryo’s zodanig dat de verschillende soorten cellen verschillende kleuren fluorescentie lieten zien. Zo konden de onderzoekers de bewegingen en het gedrag van de cellen bij belangrijke veranderingen van het embryo goed volgen.
Van embryo’s van zoogdieren weten we al dat ze beginnen als een klompje cellen waarin een verdikking van cellen ontstaat. Deze langgerekte verdikking wordt de primitiefstreep genoemd. Uiteindelijk ontwikkelt de streep zich tot een geultje en daaruit ontstaat het mesoderm. Het mesoderm is de middelste cellaag van het embryo en vormt onder andere de botten en spieren.
‘We wisten eerst niet precies hoe embryo’s dit geultje vormen, maar we hebben nu de opeenvolgende stappen ontdekt’, zegt Zernicka-Goetz. ‘Het vormt de basis voor het totale lichaamsontwerp.’
‘Het werk is een mooie aanvulling op het stamcelonderzoek en kan worden uitgebreid naar het onderzoek van menselijke stamcellen’, zegt Leonard Zon van de Boston Children’s Hospital, Massachusetts. ‘Door deze vorm van stamcelkweek te gebruiken, kunnen onderzoekers de ontwikkeling van embryo’s goed bestuderen en zo kunnen we beter begrijpen welke factoren er allemaal een rol spelen in de vroege ontwikkeling.’
Robin Lovell-Badge van The Francis Crick Institute in Londen zegt dat deze embryo’s wel twee andere cellagen missen. Deze cellagen, het ectoderm en het endoderm, zijn nodig voor de ontwikkeling van de huid, het zenuwstelsel en andere organen.
Zernicka-Goetz hoopt dat deze cellagen zullen ontwikkelen in toekomstige experimenten waarbij ook stamcellen worden toegevoegd die normaal de dooierzak vormen. Dit is een zak die aan het embryo vastzit en waar de eerste bloedcellen ontstaan.
Verborgen stappen
Huidig onderzoek naar menselijke stamcellen is beperkt doordat wetenschappers alleen restembryo’s kunnen gebruiken die uit in-vitrofertilisatie (ivf) afkomstig zijn. De nieuwe methode met stamcellen kan een onbeperkte voorziening van embryo’s produceren en maakt het onderzoekers makkelijker om de diepte in te gaan met hun onderzoek. Waarschijnlijk kunnen ze beter sleutelen aan deze embryo’s en zo goed bekijken welke verschillende factoren invloed hebben op de ontwikkeling van een embryo.
Toch kunnen deze embryo’s in het lab niet uitgroeien tot baby’s. Lovell-Badge zegt dat de kunstmatige embryo’s niet veel verder zullen ontwikkelen, omdat ze snel voedingstoffen en zuurstof nodig zullen hebben. De moeder geeft die normaal via de placenta.
‘We zijn niet van plan om een muis in het lab te maken met stamcellen’, zegt Zernicka-Goetz. Wel hoopt ze dat het toevoegen van dooierzak-stamcellen ervoor zorgt dat de kunstmatige embryo’s lang genoeg overleven om de ontwikkeling van bepaalde organen, zoals het hart, te volgen.
Altijd op de hoogte blijven van het laatste wetenschapsnieuws? Meld je nu aan voor de New Scientist nieuwsbrief.
Lees verder:

