In de nabije toekomst hebben we geen geslachtscellen, en zelfs geen baarmoeder, meer nodig voor het maken van een nieuw mens. Daarmee zijn we op een punt beland waarop we tegen controversiële grenzen aanlopen. Is het het waard om die grenzen te verleggen?
Al negen jaar probeerden Lesley en John Brown een kindje te krijgen. Lesleys eileiders waren afgesloten en op een natuurlijke manier zwanger worden leek uitgesloten. Ze kregen opnieuw hoop toen ze in 1977 hoorden van een experimentele behandeling aan de Universiteit van Cambridge in het Verenigd Koninkrijk, waarbij de bevruchting buiten het lichaam plaatsvindt. En die hoop deed leven – letterlijk. Hun dochter Louise Brown was een medisch wonder.
Dat ging alleen niet zonder slag of stoot. Aan Louises geboorte op 25 juli 1978 gingen 331 mislukte bevruchtingen bij 282 vrouwen vooraf, en meer dan tien jaar aan wetenschappelijk geploeter. En hoewel nu, zo’n veertig jaar later, de techniek van in-vitrofertilisatie (een bevruchting in een kweekschaaltje) wel iets is verbeterd, is die met een slagingskans van 30 procent toch nog verre van optimaal.

Om die slagingskans te verbeteren, moeten we het embryo beter leren begrijpen. Zeker over de heel vroege ontwikkeling van het embryo is weinig bekend. Onze kennis is grotendeels gebaseerd op onderzoek in proefdieren, die zich anders ontwikkelen dan mensen, en schaarse studies met menselijke embryo’s. De gaten in die kennis zijn niet alleen het gevolg van de ongelooflijke complexiteit van het embryo, maar hebben ook te maken met de ethische kwesties die spelen zodra we reppen over embryo-onderzoek. Er zijn alternatieven die soelaas bieden, maar ook die behoeven voorzichtigheid en debat. Want wanneer is iets een embryo, en wanneer niet?
Embryonale stamcellen zijn in staat om in alle verschillende soorten lichaamscellen te veranderen
Kostbaar materiaal
In-vitro fertilisatie, of ivf, was een grote doorbraak op het gebied van voortplantingsonderzoek en heeft al onnoemelijk veel mensen ouders gemaakt die dat zonder ivf niet hadden kunnen worden. Maar het heeft ook een bijeffect: het levert embryo’s waarop onderzoek gedaan kan worden. Bij elke ivf-behandeling worden namelijk meerdere embryo’s ontwikkeld, waarvan er dan een of twee worden teruggeplaatst bij de vrouw. Er blijven dus embryo’s over, van drie tot vijf dagen oud, die niet goed genoeg zijn om te gebruiken voor een zwangerschap. Deze embryo’s kunnen – uiteraard met uitdrukkelijke toestemming – gebruikt worden voor wetenschappelijk onderzoek.
Uit zo’n ivf-embryo isoleerde James Thomson in 1998 voor het eerst menselijke embryonale stamcellen, de speciale cellen waaruit een embryo bestaat. Deze stamcellen zijn in staat om in alle verschillende soorten lichaamscellen te veranderen, zoals zenuwcellen, spiercellen of huidcellen. Ze worden ook wel pluripotent genoemd – van het Latijnse pluri (veel) en posse (kunnen). De ontdekking van deze cellen betekende een enorme vooruitgang in het stamcelonderzoek en maakte het bovendien mogelijk om de vroege ontwikkeling van het menselijk embryo nog beter te bestuderen.
Ivf-embryo’s zijn onmisbaar voor embryo-onderzoek, zo laat de ontdekking van embryonale stamcellen zien, maar voor het uitvoeren van goed onderzoek zijn het er relatief weinig. Dat is meteen het grootste obstakel bij embryo-onderzoek, zegt Niels Geijsen, stamcelbioloog aan de Universiteit Leiden. ‘In onderzoek is herhaling van experimenten heel belangrijk, en dat is lastig met schaarse menselijke embryo’s.’ Bovendien is het onderzoek aan allerlei wet- en regelgeving verbonden.

Verre van perfecte replica
Ontwikkelingen in het stamcelonderzoek bieden mogelijk een alternatief voor kostbare ivf-embryo’s. Stamcellen blijken onder de juiste omstandigheden namelijk samen te klonteren tot zogenoemde embryoachtige structuren. Die vormen een mooi 3D-model van echte embryo’s.
In 2017 maakten Amerikaanse onderzoekers voor het eerst met menselijke embryonale stamcellen een model voor een bepaald stadium in de embryonale ontwikkeling. In maart 2021 publiceerden twee onderzoeksteams onafhankelijk van elkaar over een model dat de vroegste fase van de ontwikkeling tot dan toe weergaf.
Voordeel van dergelijke embryoachtige structuren is dat ze dusdanig verschillen van echte embryo’s dat ze niet aan de strenge wet- en regelgeving van onderzoek met echte embryo’s hoeven te voldoen. Toch lijken ze er genoeg op om de vroege ontwikkeling te onderzoeken.
‘Deze structuren zijn in een middagje met honderden tegelijk te maken. Ineens is de hoeveelheid materiaal geen beperkende factor meer voor het onderzoek’, zegt Geijsen. Dit maakt de resultaten bovendien een stuk nauwkeuriger, want experimenten kunnen gemakkelijker herhaald worden.
Daarbij willen wetenschappers de bestaande modellen blijven verbeteren, zegt Geijsen. ‘Het is geen doel op zich om een perfecte replica van een embryo te maken, maar we willen het model wel zo veel mogelijk op de werkelijkheid laten lijken.’ En daar zit het ethische spanningsveld. Want inderdaad, als het model steeds meer gaat lijken op de werkelijkheid, zal het wellicht gaan vallen onder dezelfde wetgeving als voor echte embryo’s. Zover is het echter nog lang niet. De imperfectie van de embryoachtige structuren maakt ze juist ontzettend interessant. Door te onderzoeken wat er misgaat, krijgen we inzicht in allerlei onverwachte factoren die een belangrijke rol blijken te spelen in de ontwikkeling.
Wilt u meer verhalen lezen zoals deze?
Word nu lid en lees de eerste maand voor slechts €1,99
- Lees onbeperkt artikelen op newscientist.nl of in de app
- Elke dag online nieuwe artikelen, achtergronden en recensies van onze redactie
- Maandelijks opzegbaar
Organen weglaten
‘Als de embryoachtige structuren ooit zodanig verbeterd kunnen worden dat het onderscheid met echte embryo’s niet meer goed te maken is, dan moeten we toch nadenken welke plaats we de embryoachtige structuren geven binnen onze discussie over embryo-onderzoek.’ Dat vindt bio-ethicus Seppe Segers van de Universiteit Gent, die onderzoek doet naar de ethische en morele aspecten van geassisteerde voortplanting, een van de thema’s binnen embryo-onderzoek.
Met deze kwestie houdt menig onderzoeker en ethicus zich bezig. Ana Pereira Daoud van de Universiteit Maastricht promoveert zelfs op dit onderwerp en vindt dat we hier nú over moeten nadenken. ‘Je wilt niet een bepaalde grens naderen of zelfs overgaan zonder erover te hebben nagedacht of dat wel oké is.’
De onderzoekers die de embryoachtige structuren ontwikkelden, claimen dat de modellen nooit het vermogen zullen hebben zich te ontwikkelen tot personen. Er is alleen geen ethische manier om dat te testen. Het zal onder geen beding worden toegestaan om de modellen in een baarmoeder te plaatsen om de verdere groei te bestuderen.
Om het zekere voor het onzekere te nemen, kun je modellen ontwikkelen die genetisch geprogrammeerd zijn om (gedeeltelijk) niet verder uit te groeien, waardoor ze nooit menselijke vermogens kunnen ontwikkelen. Geijsen: ‘Dan kun je de ontwikkeling van bepaalde organen wel steeds verder verbeteren, maar je voorkomt dat je iets maakt dat te veel op een echt menselijk embryo gaat lijken.’ Pereira Daoud zegt dat hier nog wel discussie over is. ‘Heeft het dan geen menselijke vermogens of wordt het ontwikkelingsvermogen in de kiem gesmoord?’ Ze vraagt zich af of we embryoachtige structuren niet als niet-levensvatbare menselijke embryo’s moeten beschouwen. ‘De vraag is dan hoe we met die categorie willen omgaan.’
Naast deze ethische kanttekening is er ook een wetenschappelijk nadeel: als je bepaalde organen uitschakelt in de ontwikkeling, kun je nooit de onderlinge invloed van organen bestuderen. Als je een heel orgaan weglaat, ontbreekt er ook iets dat mogelijk belangrijk is voor de ontwikkeling. Geijsen: ‘Op het moment dat je mogelijkheden afsluit, weet je niet wat dat voor effect gaat hebben op de rest.’
Embryo’s mogen niet langer dan veertien dagen in een lab in leven worden gehouden
Veertiendagenregel
Er is nog iets wat grote doorbraken in het voortplantingsonderzoek in de weg staat: de zogenoemde veertiendagenregel. Al ruim veertig jaar geldt de regel dat natuurlijke embryo’s niet langer dan veertien dagen in een laboratorium in leven mogen worden gehouden. Dat getal is toen gekozen omdat rond die tijd de primitiefstreep ontstaat, de voorloper van het brein en ruggenmerg. De primitiefstreep markeert ook het moment waarop het embryo zich nog kan splitsen in een tweeling én dat de drie kiemlagen ontstaan waaruit de rest van het embryo zich ontwikkelt.
Het leek een veilige grens, ver weg van ons kunnen. Destijds lukte het om een embryo zes, hooguit zeven dagen in leven te houden. Door ontwikkelingen van de laatste jaren zijn we nu veel verder. Die technische vooruitgang is mede te danken aan Pools-Britse ontwikkelingsbioloog Magdalena Zernicka-Goetz, die haar wetenschappelijke en persoonlijke reis vastlegde in het boek The Dance of Life. Met haar team ontrafelde Zernicka-Goetz een aantal belangrijke mechanismen die in de eerste twee weken cruciaal zijn voor het embryo, waardoor we die vroege fase ook beter kunnen nabootsen in het lab.
Haar onderzoeksgroep was in 2016 een van de eerste die in staat was een embryo twaalf of dertien dagen in het lab in leven te houden. Toen braken ze het experiment af, omdat de huidige ethische en juridische richtlijnen dat voorschrijven. Vóór die doorbraak hadden wetenschappers er geen problemen mee om zich aan die veertiendagenregel te houden bij het gebruik van embryo’s. Nu we die grens naderen, lijkt het debat opnieuw geopend.
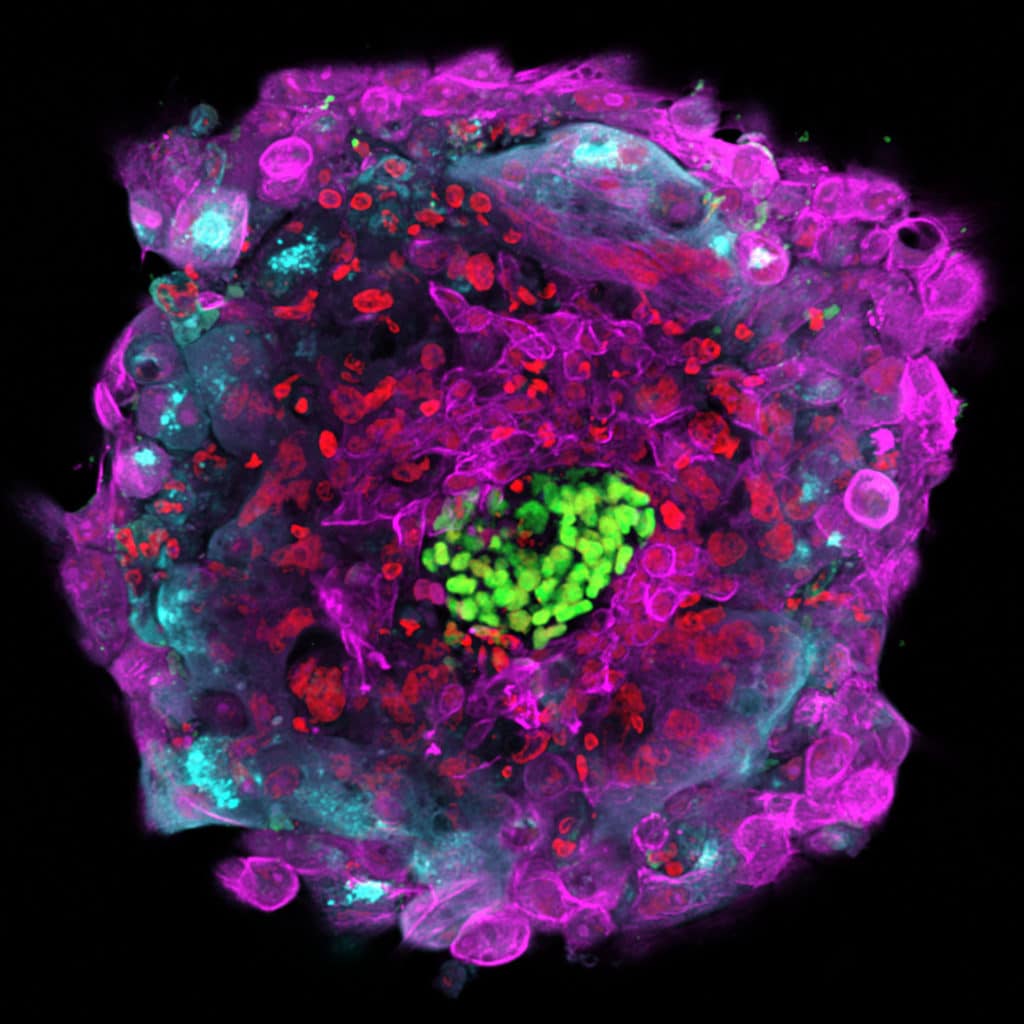
Black box
Want wat gebeurt er na die veertien dagen? Daar hebben we slechts een vaag idee van. En dat terwijl dag 15 tot en met dag 28 van de ontwikkeling cruciaal zijn: in essentie worden alle organen aangelegd, al zijn ze nog heel pril en onvolwassen. Er kan van alles misgaan, maar hoe precies weten we niet. Die periode wordt niet voor niets de black box genoemd – allerlei medische problemen ontstaan in dit stadium: onvruchtbaarheid, miskramen en genetische aandoeningen. ‘De black box bevat veel antwoorden’, zegt Segers.
Nu geldt de veertiendagenregel alleen voor echte embryo’s. Omdat embryoachtige structuren op dit moment nog heel ver van de werkelijkheid afstaan, vallen deze nog niet onder die regel. Toch is deze kwestie ook van belang voor embryoachtige structuren. De modellen moeten voorbij de veertien dagen vergeleken kunnen worden met embryo’s om te kunnen testen of ze daadwerkelijk goede alternatieven zijn voor het echte werk, zegt Geijsen. ‘We hebben weinig referentiepunten in de mens voor deze periode.’
Dat het verkennen van de periode na veertien dagen aanzienlijke voordelen kan opleveren, wordt inmiddels ook erkend door de International Society for Stem Cell Research (ISSCR), de internationale organisatie voor stamcelonderzoek. Die maakte op 26 mei 2021 bekend haar veertig jaar oude veertiendagenregel te versoepelen. Deze richtlijn vormt de basis voor veel nationale en internationale wetgeving. Nu stelt de ISSCR dat de grens helemaal moet verdwijnen en we per geval moeten beoordelen of het langer in leven houden van embryo’s geoorloofd is of niet. Veel onderzoeksvragen kunnen namelijk ook opgelost worden binnen die veertien dagen of met imperfecte embryomodellen. Dat ligt dan misschien minder gevoelig dan de onderzoeksvragen die echt die black box in duiken.
‘Een gebrek aan heldere definities roept de vraag op of de wet beschermt wat die zou moeten beschermen’
Gebrek aan helderheid
Maar wat maakt dat we het ene eerder aanvaarden dan het andere? Dat brengt ons bij de vraag wat een embryo nu eigenlijk is. Strikt wetenschappelijk zijn er twee criteria om iets als menselijk embryo te definiëren. Ten eerste hebben we het alleen over een embryo tussen de bevruchting en de negende week van de ontwikkeling. Daarna spreken we van een foetus. Ten tweede heeft een menselijk embryo per definitie menselijk DNA.
‘Die wetenschappelijke definitie wordt algemeen erkend’, zegt Pereira Daoud. ‘Toch bestaat er in wet- en regelgeving geen universele definitie van het menselijk embryo. Ze verschilt nogal tussen landen.’ Zo spreekt men in Spanje pas van een embryo als dat het product is van de bevruchting van een eicel door een zaadcel. Wat er mankeert aan die definitie, illustreert Pereira Daoud met het schaap Dolly. Dat is tot stand gekomen door klonering in plaats van bevruchting. Dolly zou volgens die definitie haar leven dus nooit als schapenembryo zijn begonnen, wat nogal tegenstrijdig is. Stel dat Dolly een mens was, dan zou deze definitie impliceren dat de vroegste fases van op die manier tot stand gebrachte mensen geen embryo’s zijn en dus ook niet de bescherming verdienen die de wet aan mensenembryo’s verleent. ‘Een irrelevante factor, de totstandkoming, zorgt dan voor een moeilijk te verdedigen verschil in behandeling’, licht Pereira Daoud toe.

Bevruchting speelt geen rol in onze eigen definitie van een embryo. Sinds 2002 is de Nederlandse Embryowet van kracht en sinds 2003 de Belgische. De definitie van een embryo is in beide wetten hetzelfde: ‘Een cel of samenhangend geheel van cellen met het vermogen uit te groeien tot een mens.’ Ook deze definitie zorgt echter voor problemen. Aanzienlijk veel ivf-embryo’s hebben niet dat vermogen om uit te groeien tot mens, en zijn volgens die definitie dus eigenlijk geen embryo. Toch behandelen we ze zo.
‘Elke poging om een embryo te definiëren kun je vergelijken met een te klein tafellaken’, legt Segers uit. ‘Je kunt dat naar je toe trekken om een bepaald deel van de tafel te bedekken, maar dan komt een ander hoekje bloot te liggen. Als je bijvoorbeeld het criterium dat er bevruchting plaats moet vinden meeneemt, sluit je misschien het criterium om uit te kunnen groeien tot een mens uit.’ We willen uiteindelijk op zoek naar een groter tafellaken, maar waarschijnlijk is geen enkele definitie allesomvattend, aldus Segers.
De nadelen zijn duidelijk, zegt Pereira Daoud: ‘Een gebrek aan heldere definities maakt het niet alleen lastig voor wetenschappers om hun werk met embryo’s of embryoachtige structuren te begrenzen, maar het roept ook de maatschappelijke en morele vraag op of de wet beschermt wat hij zou moeten beschermen.’
De morele waarde die we toekennen aan een wezen heeft te maken met het vermogen om pijn te kunnen lijden
Afwegingen
Wat betekent een embryo precies voor ons? Iedereen is het erover eens dat een menselijk embryo respect verdient, al is het lastig te verwoorden wat dat precies inhoudt. ‘Er zijn veel manieren om ernaar te kijken. Daarom is het ook zo lastig en wordt al zo lang bediscussieerd hoeveel waarde een embryo nu heeft’, zegt Pereira Daoud.
In 2019 deed het Rathenau Instituut in Den Haag onderzoek naar de mening van de Nederlandse bevolking over embryo-onderzoek. Daaruit bleek dat mensen niet lijnrecht over elkaar staan als het gaat over embryo-onderzoek, maar dat er een grote verscheidenheid aan argumenten is. Door al die verschillende meningen aarzelen mensen om in te stemmen met het veranderen van regels rond embryo-onderzoek, zo blijkt uit het rapport van het Rathenau.
Dat spectrum aan meningen wat betreft respect en morele status van het embryo is op te delen in grofweg drie posities. Onder meer de Rooms-Katholieke Kerk vindt dat een embryo vanaf conceptie een mens in potentie is, en dus ook evenveel respect moet krijgen en hetzelfde behandeld dient te worden als ieder mens. Aan het andere uiterste van het spectrum heb je mensen die een embryo zien als slechts een klompje stamcellen die je niet anders hoeft te behandelen dan elke andere menselijke cel in een laboratorium.
Daar tussenin heb je de groep die zegt dat hoe ouder een embryo is, hoe meer respect het verdient. De morele waarde die we toekennen aan een wezen heeft te maken met het vermogen om pijn te kunnen lijden en het vermogen om zich tot een persoon te ontwikkelen. Deze twee eigenschappen bepalen ook of embryoachtige structuren dezelfde morele status als embryo’s zouden moeten krijgen.
Hoe kom je met al deze standpunten tot beslissingen over wat er wel en niet mag binnen het embryo-onderzoek? Discussie is heel belangrijk, zegt ook Segers. En om een weloverwogen standpunt te kunnen innemen over zoiets als embryo-onderzoek is voldoende informatie essentieel. Daar ontbreekt het soms aan, meent Segers. ‘Er wordt heel veel over gesproken, maar de informatie die aan de basis ervan zou moeten liggen, is grotendeels ontoegankelijk.’
Ontbrekende stukjes
Naast embryo’s en embryoachtige structuren zijn er nog meer technieken die een rol kunnen gaan spelen in voortplantingsonderzoek. ‘De komst van kunstmatige baarmoeders, het knip-en-plakwerk van CRISPR: wat kunnen we daar allemaal mee?’ zegt Pereira Daoud. ‘Al die technieken gecombineerd openen een wereld aan mogelijkheden, waar wij misschien nog niet goed genoeg over hebben nagedacht.’
Die nieuwe technieken kunnen bijdragen aan onze kennis over mislukte zwangerschappen, vruchtbaarheidsproblemen en de ontwikkeling van het embryo, die nog altijd gaten bevat. Door de inzet van embryo’s, cellen en modellen zal de wetenschap de ontbrekende stukjes van die puzzel op zijn plek proberen te leggen. Met alle ontwikkelingen van de afgelopen jaren staat de volgende grote doorbraak, zoals de geboorte van Louise Brown, voor de deur te wachten – totdat we het aandurven om die open te doen.
Dit premium artikel las u gratis
Meer verhalen lezen zoals deze? Als u nu instapt leest u de eerste maand al voor €1,99!
- Lees onbeperkt artikelen op newscientist.nl of in de app
- Elke dag online nieuwe artikelen, achtergronden en recensies van onze redactie
- Maandelijks opzegbaar
Dit artikel is verschenen in New Scientist 96. Deze editie vind je in ons digitaal archief.
