Fundamenteel onderzoek is niet alleen belangrijk omdat het ons kennis verschaft over onszelf en de wereld om ons heen. Vaak leidt het tot verrassende toepassingen. Deze drie voorbeelden laten zien hoe we vandaag de dag de vruchten van zulk fundamenteel onderzoek plukken.
CT-scans
Sir Aaron Klug
Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica 1979
Naar eigen zeggen was zijn lot bezegeld toen hij halverwege de jaren vijftig de prachtige röntgendiffractiepatronen van Rosalind Franklin zag, waarmee je de structuur van moleculen kunt ontrafelen. De Britse biochemicus Aaron Klug was in 1953 aan de slag gegaan bij Birkbeck College in Londen, waar Franklin op dat moment al werkte. Samen met haar stortte hij zich op het bepalen van de structuur van het tabaksmozaïekvirus. In de jaren die volgden, ontrafelde Klug samen met collega’s de structuur van niet alleen dit virus, maar ook een heleboel andere virussen en moleculen.
Hoe een ‘ansjovisrolletje’ en peesbanden helpen tegen pijnlijke duimbasisartrose
Slijtage van het kraakbeen in de duimbasis en in het polsgewricht kan gemeen pijn doen. Tijd om een dokter te raadplegen. Pla ...
Dat leverde een schat aan kennis op. Maar ook van de methoden die Klug hiervoor ontwikkelde plukken we direct de vruchten. Zo is hij de grondlegger van de zogeheten kristallografische elektronenmicroscopie. Hierbij maak je eerst een heleboel tweedimensionale afbeeldingen vanuit verschillende hoeken. Vervolgens combineer je die met behulp van computerberekeningen tot een driedimensionaal model.
Klugs techniek en de bijbehorende berekeningen waren een belangrijk ingrediënt voor de ontwikkeling van de CT-scanner, die tegenwoordig in elk ziekenhuis te vinden is. Een CT-scanner maakt ook eerst röntgenfoto’s van een lichaamsdeel vanuit verschillende hoeken. De computer voegt vervolgens al die foto’s samen, reconstrueert hoe het lichaam eruitziet en maakt daarvan een collectie dwarsdoorsneden van het lichaamsdeel. Hiermee kunnen artsen organen en botten in groot detail bekijken.
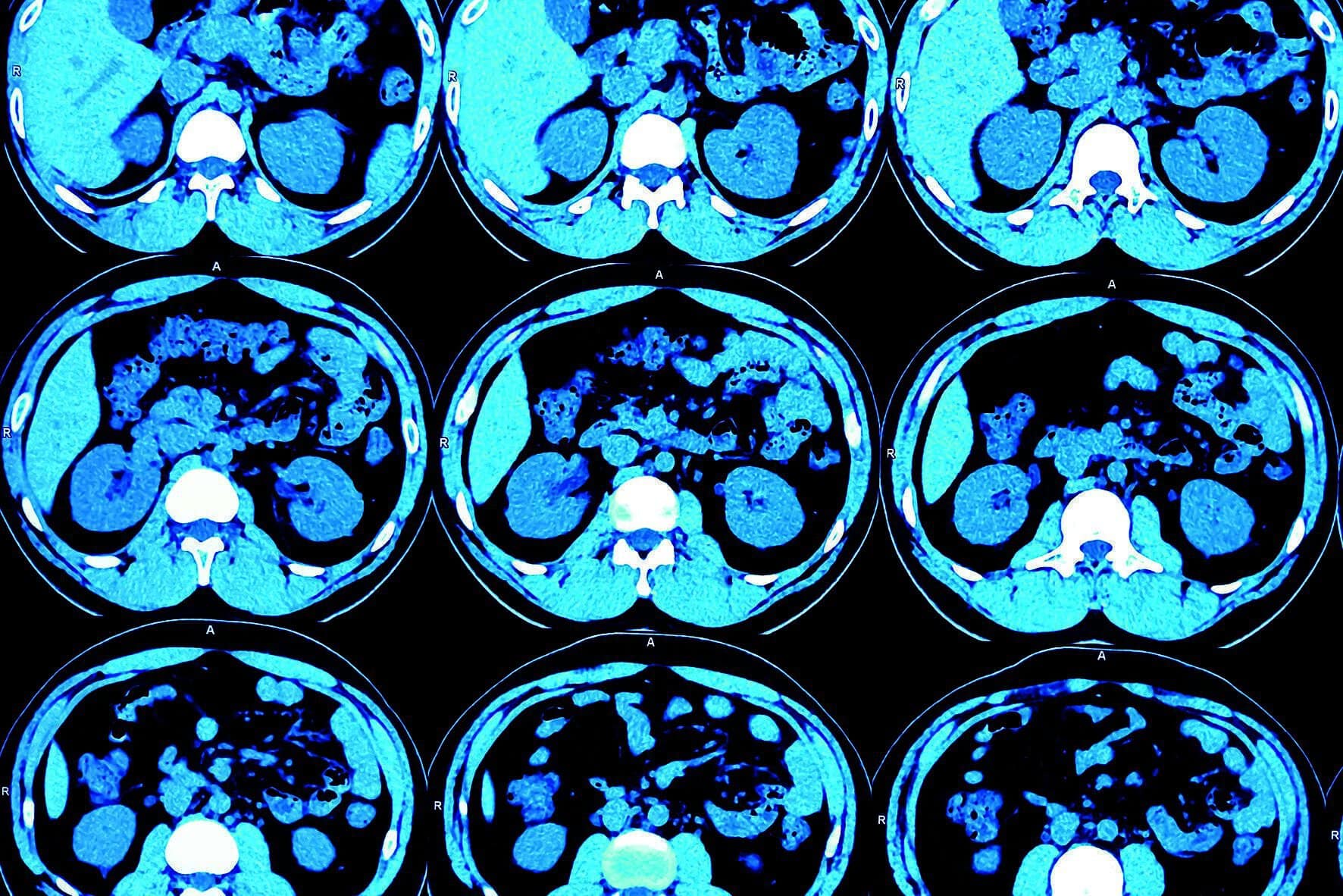
De genetische vingerafdruk
Sir Alec Jeffreys
Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica 2006
Ondanks de gigantische verschillen tussen mensen, is 99,9 procent van ons DNA gelijk. De overige 0,1 procent zorgt voor alle variatie die we om ons heen zien. De Britse geneticus Alec Jeffreys richtte zich eind jaren zeventig op precies dat gedeelte. Hij wilde de verschillen tussen het DNA van individuen vinden en begrijpen.
Toen hij een specifiek gen van zeehonden onderzocht, vond Jeffreys een stukje DNA dat zichzelf een aantal keer herhaalde – alsof de DNA-code een aantal keer ‘stotterde’ voordat hij zijn code vervolgde. Vergelijkbare stotterende stukjes DNA was hij in de recente literatuur ook al tegengekomen. Het aantal herhalingen bleek bovendien niet bij elk individu hetzelfde.
Jeffreys besloot dit gen nader te bestuderen in DNA-monsters van een aantal verschillende individuen: onder andere van zijn labtechnicus en haar ouders, maar ook van een koe, een aap en een tabaksplant. Met behulp van radioactief gelabelde stukjes DNA die precies aan de herhalende stukjes bonden, kon hij in kaart brengen hoe vaak bepaalde stukjes DNA in verschillende monsters herhaald werden.
Toen Jeffreys ’s ochtends op 10 september 1984 zijn lab binnenkwam om het resultaat te bekijken, zag hij dat het herhalende DNA van elk individu een uniek patroon opleverde. Bovendien bleek het patroon van de technicus een combinatie van de patronen van haar ouders. Hij realiseerde zich dat hij was gestuit op een manier om mensen op basis van hun DNA te identificeren.
Daarna ging het snel. In 1985 werd Jeffreys benaderd door advocaten die een jongen bijstonden die gedeporteerd zou worden. De jongen zou niet de biologische zoon van een Britse vrouw zijn en daardoor geen recht hebben op de Britse nationaliteit. Jeffreys besloot te helpen, en kon met behulp van de DNA-vingerafdruk aantonen dat de jongen wel degelijk de biologische zoon van de vrouw was. De jongen mocht blijven. Ruim een jaar later kon Jeffreys met de DNA-vingerafdruk de onschuld aantonen van een man die verdacht werd van het verkrachten en vermoorden van twee schoolmeisjes. Na flink wat speurwerk kon de politie de echte dader oppakken, en wederom met behulp van de DNA-vingerafdruk aantonen dat hij de schuldige was.
Sindsdien is de DNA-vingerafdruk uitgegroeid tot een onmisbaar instrument op allerlei gebieden – van forensisch onderzoek tot het achterhalen van familiebanden.
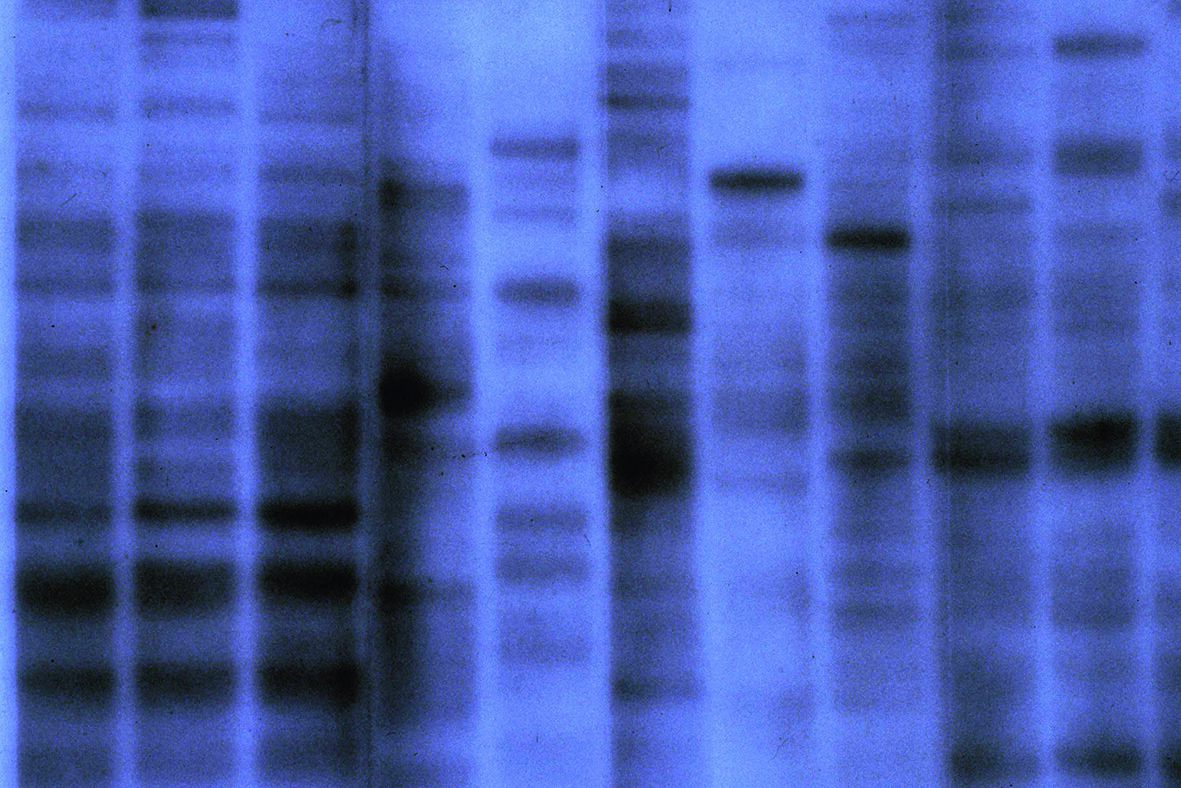
Knippen en plakken met DNA
Jennifer Doudna
Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica 2016
In 2006 werkte de Amerikaanse biochemicus Jennifer Doudna al ruim twintig jaar zeer verdienstelijk met RNA, toen ze in aanraking kwam met CRISPR’s. Dat zijn stukjes DNA-code die telkens terugkomen in het DNA van bacteriën. Tussen die herhalende stukjes zit steeds een uniek stukje code. Toen Doudna het veld betrad, was de heersende opvatting al dat CRISPR’s deel uitmaken van een immuunsysteem van bacteriën. Men vermoedde dat als een bacterie een virusinfectie heeft overleefd, de bacterie een stukje DNA van dat virus in haar genoom plaatst, zodat ze na een volgende infectie het virus direct kan herkennen en aanvallen.
Naast de CRISPR’s hadden onderzoekers, onder wie de Nederlandse microbiologen Ruud Jansen en John van der Oost, ontdekt dat er een groep eiwitten is die zich in de buurt van het CRISPR-DNA ophoudt. Jansen noemde deze groep als eerste ‘Cas-eiwitten’: CRISPR-associated.
Doudna stortte zich op het ontrafelen van de functies van deze eiwitten. Ze was geïntrigeerd door het feit dat deze eiwitten leken op al bekende eiwitten die DNA kunnen afwikkelen en knippen. Ze vroeg zich af of de Cas-eiwitten een vergelijkbare functie konden hebben en wellicht virusDNA kapot konden knippen.
Het onderzoek kwam in een stroomversnelling toen ze samen ging werken met de Franse microbioloog Emmanuelle Charpentier. Die bestudeerde destijds het immuunsysteem van de bacterie Streptococcus pyogenis, een veel eenvoudiger systeem dan dat wat Doudna onderzocht. Bij deze bacterie was er slechts één Cas-eiwit, Cas9, nodig om een virus te verslaan. Samen ontrafelden Charpentier en Doudna hoe het verdedigingssysteem precies werkte.
Versimpeld komt het hierop neer: het CRISPR-DNA wordt eerst gekopieerd naar een CRISPR-RNA-molecuul. Hier knipt het Cas9-eiwit met behulp van een ander molecuul een stukje unieke code uit dat tussen de herhalende CRISPR’s zit. Dit kun je zien als een puzzelstukje dat precies op het DNA van de virale indringer past. Als het Cas9-eiwit DNA tegenkomt dat op zijn puzzelstukje past, dan weet hij dat hij met deze indringer te maken heeft, en knipt hij dit DNA doormidden. Het virus is verslagen.
Hiermee hadden Charpentier en Doudna blootgelegd hoe het verdedigingssysteem werkt. Maar de volgende stap was cruciaal: ze onderzochten of ze deze genetische tool zodanig konden aanpassen dat ze DNA konden knippen op een locatie die ze zelf bepaalden.
Dat bleek inderdaad mogelijk. Doudna en Charpentier konden de code die Cas9 meenam aanpassen, en ervoor zorgen dat het eiwit DNA op precies de gewenste plaatsen doorknipte. In 2012 publiceerden ze hun ontdekking van de genetische CRISPR/ Cas9-schaar. Sindsdien is het onderzoeksveld geëxplodeerd. Met deze schaar bleek je genen eenvoudig te kunnen aanpassen – ook in mensen. Je kunt het DNA op een bepaalde plek wegknippen, en daar vervolgens een ander stuk DNA invoegen.
Inmiddels is CRISPR/Cas9 uitgegroeid tot een standaardgereedschap, met veel nuttige en veelbelovende toepassingen. Denk bijvoorbeeld aan het aanpassen van landbouwgewassen om ze beter bestand te maken tegen droogte. Een van de gedroomde functies van CRISPR/Cas9 is het behandelen van erfelijke ziekten. Ondanks de ethische vragen die de techniek oproept – hoever wil je gaan met het aanpassen van DNA? – heeft de techniek een zeer waardevolle invloed in uiteenlopende gebieden.
60 jaar Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica
In 2024 vieren de Heinekenprijzen, de grootste internationale wetenschapsprijzen van Nederland, hun 60-jarige jubileum. Ter ere van dit jubileum duiken we in de geschiedenis van de prijs waar het mee begon: de Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica. Wetenschappers die deze prijs de afgelopen 60 jaar ontvingen, ontrafelden onder meer de geheimen van DNA, cellen en eiwitten. Daarmee legden ze de basis voor nieuwe medische toepassingen.
Dit artikel kwam tot stand in samenwerking met de Stichting Alfred Heineken Fondsen.
